1. Ørsmå endring i startbetingelser -gir enorme endringer
Zygoter er få av antall (i forhold til øvrige celler), og de fleste vitenskapsfolk benytter celler fra bitte-litt senere i utviklingen: de såkalte Embryonale Stamcellene (ES). Zygoten deler seg noen få ganger, for å gi opphav til et knippe celler som kalles blastocyst (foster-blære). Blastocysten er allerede et tidlig foster, med to ulike avdelinger: Det ytre laget (trophectoderm) og Indre CelleMasse (ICM). Under spesifikt kontrollerte laboratorieforhold, kan celler fra ICM bli en kultur av pluripotente embryonale stamceller.
Pluripotente innebærer at de kan utvikle seg til alle typer celler, men unntak av morkaken. Shinya Yamanaka har identifisert gener og proteiner som er uttrykt i ES-celler. Gener som holder cellen i pluripotent tilstand, er meget viktige -fordi ES-celler er meget følsomme. En ørliten endring i betingelsene cellen lever i, og den endrer seg f.eks. til nevroner i hjernen. En annen ørliten endring og de utvikler seg til hjerte-celler.. De identifiserte massevis av celler som var viktige for å holde cellen i pluripotent tilstand. Les mer.

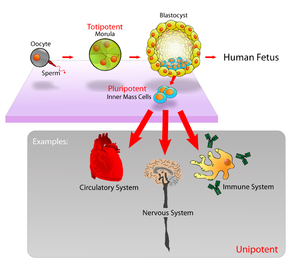
Bilde 1A. Foster i tidligste stadier 1B. Tidlige celle-utvikling
2. Fintilpasset balanse mellom aldring og kreft (telomer-lengde)
Om telomerer i enden av kromosomene blir for korte, tenderer cellen mot å lukkes. At celler lukkes, er en mulig forsvarsmekanisme mot risikoen for nye kreft-induserende gener. Men om telomerene blir for lange, så er det økt sjanse for at ulike kromosomer lenker seg sammen, med mulig utfall i form av kreft etc. En følge er at det er meget vanskelig å skape medisiner som forlenger livet, uten samtidig å øke risikoen for kreft. Telomer-systemet er fint balanser, likesom avbalansering mellom aldring og kreft.
Bilde 2. Telomerer av ulik lengde

3. Perfect match
I endodermen (frøhviten) er det noen omflyttbare elementer (Transposable Elements), som er slått på. Ut fra disse TE, skaper cellene i endodermen små RNA molekyler. De finner TE-ene i embryoets genom, som har samme sekvens som dem selv. Disse små RNA-molekylene synes så å rekruttere maskineriet som permanent inaktiverer disse potensielt farlige, genomiske elementene. Pattedyr inaktiverer den relevante kopien av det påtrykte genet, ved DNA-metylering.
Bilde 3. Skal passe 3-dimensjonal
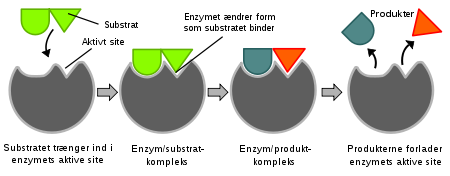
4. Spesifikke epigenetiske endringer
I kreftforskningen pågår for tiden stor oppmerksomhet omkring utvikling av medisiner som undertrykker mer spesialiserte epigenetiske enzymer. F.eks. enzymer som endrer tilpasning av én spesifikk aminosyre-posisjon på histon-proteiner. I kreftceller mister gener sine vanlige metylerte vedheng, de blir demetylerte. Dette resulterer i en masse unormal gen-aktivitet, hvorav ukontrollert celle-formering er én. Mye medisinsk epigenetisk forskning settes inn på å reversere sykelige, epigenetiske begivenheter. (1)
Folinsyre, som er nødvendig for produksjon av SAM (S-Adenosyl-Methionine), danner metylgruppen som trengs når DNA metyleres. Om rotteunger gis en diett som har lite folinsyre, utvikler de abnorme reguleringer på uttrykte regioner av genomet (2). En er i startfasen av å finne ut fordelaktige effekter av folinsyre, som kan formidles via epigenetiske mekanismer.
Bilde 4. Samvirke metylering og histon de-acetylering

5. Bevaring av genetiske celletyper
Kunnskapen om hvordan spesifikke modifikasjoner blir etablert ved utvalgte posisjoner i genomet, er foreløbig meget ufullstendig. Vi begynner å se en rolle for ikke-protein-kodende RNA i prosessen, men forskerne er i startfasen. Hvordan histon-modifikasjoner overføres fra mor til datter-celler, er uvisst, men de er temmelig sikre at det skjer som del av en cellulær hukommelse, som gjør at cellens type kan bevares. Manglende histon-modifikasjoner i replikert DNA blir korrigert meget raskt. Dette er ett fundamentalt emne innen epigenetikken, men står foreløbig uten løsning. Det kan være at en tenker for todimensjonalt om saken (se pkt. 6).
Bilde 5. Ulike celletyper i kroppen

6. 3-dimensjonal passform
En har blitt vant til å tenke på genomet som en streng av baser, som bare leses rett fram. Likevel er virkeligheten at ulike regioner av genomet vrir og folder seg, og strekker seg ut mot hverandre for å danne nye kombinasjoner og regulerende under-grupper. Folding av protein er nylig blitt knyttet til behandling av sykdom. Slike studier har vist at proteinets folding påvirker dets funksjoner. (3) En studie publisert i 2012 der forskere så på H3K4me3 mønstre i felles hjerne-gener, uttrykt i vev. De oppdaget og karakteriserte 471 ulike gen-regioner med menneske-spesifikke tilføyelses eller slettings- mønstre, som ikke ble funnet i sjimpanse (4). Forbløffende nok fant de at majoriteten av disse spesifikke histonprofiler fra hjernegener (410/471) hadde samme metyleringsmønstre i spermier, som indikerte at endringene var del av et varig, arvelig epigenetisk repertoar for mennesker, men ikke for sjimpanser. Da forskerne undersøkte hvordan disse histon-endringene ville påvirke den tre-dimensjonale struktur til genene, viste de at disse genetiske effektene var relatert til ulikheter i 3-D-forming i kjernen, som var unik for mennesket.
Bilde 6. Hemoglobin -3 dim. foldet

7. Epigenetikken overstyrer DNA
Kjernen i ei celle inneholder den store majoriteten av DNA/gener som er vår kopimal. Da vi først lærte om celler på skolen, var det omtrent som på Darwins tid: cellekjernen styrte det hele, og cytoplasmaet omkring kunne ikke utrette mye. Men ingenting er lengre fra sannheten, spesielt hva egg angår. Det kan vi bl.a. lære av sauen Dolly. Noe i cytoplasmaet i egget, reprogrammerte den voksne kjernen, som forskerne injiserte i det. Det endret kjernen fra en differensiert jurcelle, til ei udifferensiert stamcelle som i zygoten (lenke).
En nyere menneske-sjimpanse DNA-metylerings undersøkelsene viste forskningen var totalt motsatt av det forskerne forventet. I dette prosjektet undersøkte forskerne cytosin metylerings-mønstre i genomet til blodceller fra mennesker, sjimpanser, gorillaer og orangutanger (5). De fokuserte spesifikt på 16 områder i kromosom 21 og 22, som er kjent for å være de mest like mellom menneske og ape-genom. Disse er ca 76% og 78% like respektivt (6)
Mønstrene og nivåene var ikke det en kunne forvente ut fra evolusjonære forutsetninger. Etter å ha undersøkt metyleringsmønstre mellom 16 regioner mellom mennesker og tre ulike aper, så benyttet de dataene til å danne et evolusjonært tre, og det var helt snudd opp-ned. Orangutanger hadde faktisk flest metylerings mønstre lik mennesket i forhold til sjimpanser og gorillaer. Dernest kom gorilla, og sjimpansen færrest. I følge standard evolusjonære mønstre, skulle det vært omvendt.
Bilde 7. Cellekjerne kunne tilbakeføres til celle som kunne gi opphav til alle celletyper

Forklaring til Bilde 7. Den befruktede eggcelle (zygoten), refereres til som totipotent. Det innebærer at den har potensiale til å forme alle celler i kroppen, inkludert morkaken.
8. Bisamfunnet. Ett sosialt tilpasset kollektiv.
Hos honningbier virker DNA-metylering som en fin-innstillings mekanisme. Det skrur aktiviteten i gener gradvis opp eller ned (7). Det er sterk positiv korrelasjon mellom mRNA-spleising og mønstre av DNA-metylering, uten at en foreløbig kan si noe om årsak/virkning her (8). At slike unike epi-genetiske egenskaper skal ha utviklet seg flere ganger, uavhengig av hverandre hos h.h.vis. maur, veps, termitter og andre bislag, synes smått utrolig. Uttrykket av ulike epigenetiske enzymer varierer i ulike sosiale grupper i koloniene (9). Les mer om Sosiale instinkter hos maur eller bier.
Bilde 8. Ulike dietter gir ulik epienetisk metylering

9. Planters utvikling: Før og etter kulde.
Nøkkelgenet som virker i fenomenet vernalisering (nedkjøling av frø), blir kalt FLC (Flowering locus C) FLC koder for et protein som kalles en transkript-undertrykker. Det binder seg til andre gen, og hindrer dem i å bli slått på. Det er tre gen som er spesielt vikige i denne sammenheng: FT, SOC1 og FD. FLC interagerer med disse genene, og kan forskyve blomstringen. Epigenetisk status til FLC endrer seg etter en periode med langvarig kulde. Slike endrede metylmønstre har vært stabile i mange år. (10)
Virkelig epigenetisk arv er mer vanlig i planter enn f.eks. i pattedyr, fordi deres epigenetiske programmering er mye mindre gjennomtrengende og grundig. Også hos mennesker kan spesielle fenomen arves i generasjoner, f.eks. er det dokumentert i Norbotten at sønnesønner av fedre med rikelig mat, hadde større tilbøyelighet til diabetes, mens sønnesønner av fedre utsatt for hungersnød, var mindre utsatt for hjerte-kar-sykdommer enn sønnesønner av de som ikke erfarte det (11). Men hos planter kommer flere epigenetiske markører seg helskinnet gjennom reprogrammerings-prosessen (12).
Bilde 9. Påvirkning av blomstring hos planter

10. Ulike epigenetiske mønstre i hjerne (ape og menneske)
I 2012 var det en forskningsgruppe som analyserte frontallappen (cortex) hos menneske- og sjimpanse- hjerner, i forhold til metyleringsulikheter i gener delt av mennesker og sjimpanser (3). Forskerne rapporterte at de "fant omfattende arts-nivå ulikheter i mønstre av DNA-metylering og at hundreder av gener utviste signifikant lavere nivå av aktivator-metylering i menneskets hjerne i forhold til sjimpanse-hjernen." Bruk av termen 'arts-spesifikke nivåer av ulikheter' indikerer at metylerings-mønsteret for disse tilsynelatende lignende gener, var totalt ulike mellom mennesker og sjimpanser, til sammen med uttrykksmønsteret. For ytterligere å understreke dette, slo forskerne fast: 'mønstrene med DNA-metylering er distinkte mellom mennesker og sjimpanse.'
Den samme studien understreket også at denne type hjerne-gener kunne tolerere meget små epigenetisk endringer, utenom den normale profilen for menneskets hjerne. Faktisk fant forskerne at unormale menneskelig hjerne-metylerings-mønstre er assosiert med en bred variasjon av alvorlige menneskelige nevrologiske sykdommer. Dette viser at endringer i metyl-endringer i hjernen ikke blir godt mottatt, og motsetter seg forestillinger om epigenetisk evolusjon hos primater og mennesker. Forfatterne gjorde flg. kommentar om denne oppdagelsen: "Endelig fant vi at differensierte metylerte gener er slående rikt utstyrt med steder assosiert med nevrologiske forstyrrelser og psykologiske sykdommer og kreft." (Fra boka ‘More Than a Monkey‘ av Dr. Jeffrey Tomkins)
Bilde 10. Epigenetiske ulikheter hos sjimpanse og menneske

11. 'Timet og tilrettelagt'
Hvis LIN-14 genet muteres, blir det feil timing på ulike stadier. Om LIN-14 proteinet er slått på for lenge, starter organismen (C.elegans orm) å repetere tidligere stadier. Dersom LIN-14 proteinet mistes for tidlig, går organismen for tidlig inn i senere larvestadier. Uansett blir organismens vekst mye forstyrret, og normale voksne strukturer utvikler seg ikke. I 1993 viste to uavhengige lab-rapporter hvordan uttrykket av LIN-14 ble kontrollert (13, 14). Uventet var nøkkel-begivenheten binding av et lite ipkRNA til LIN-14 mRNA-molekylet. Det viser eks. på stilning av gen etter transkripsjon (avskrift) av genet. mRNA dannes, men hindres i å generere protein.
Om informasjonen i DNA og kromosomer skulle vært dannet av ikke-styrte prosesser ved prøving og feiling, ville en knapt vente å finne ikke-tilfeldig funksjons-spesifikk informasjon med genetiske filer, inni mapper, som er inni supermapper og isochores. En ville heller ikke vente at celler ville produsere gen-produkter med presis målstyrt og spesifikk effektivitet, om de var dannet ved tilfeldige mutasjoner. Den hierarkiske strukturen med mange slags informasjon knyttet til det samme biologiske mediet, synes å ha krevd beydelig planlegging og forberedelse. Alt dette er med å styrke forklaringsevnen og gjøre id (intelligent design) til den beste, mest årsaks-tilstrekkelige forklaring for opphavet til og dannelsen av cellens informasjonssystem.
Bilde 11. Regulering av utvikling (Lin 14)

12. DNA-kopiering er omstendelig, og feil kan være ødeleggende
De to hoveddelene som DNA-spiraltrappen består av, trekkes fra hverandre, og det store antallet proteiner som benyttes i kopierings-arbeidet går til verks. Replikerings-maskineriet beveger seg langs hver enkelt DNA-halvdel, og bygger opp en tilsvarende ny, som motsvarer den. Avlesningsmekanismen gjenkjenner en spesifikk base, f.eks. C (Cytosin), og setter alltid G i motsatt posisjon i den halvdelen som bygges. Cellen kan altså benytte eksisterende DNA som mal (template), for å tilberede den andre halvdelen.
Bilde 12. DNA-kopiering
Om noe skulle gå feil, som det gjør meget sjelden, la oss si at T settes inn der C skulle ha vært: da har cellen et eget DNA reparerings-maskineri. Den kjenner da at 'DNA-glidelåsen' ikke er helt lukket, og feilen repareres vanligvis meget hurtig, ved at et annet sett av proteiner gjenkjenner at dette har skjedd, tar ut den feilaktige basen, og setter i den riktige. For å produsere nytt DNA, trengs altså både DNA, RNA og proteiner. Om vi tenker oss en feil i en tekstlinje, så kan hele meningen endres, ved en enkelt trykkleif. På samme måte kan en feilaktig endring (mutasjon) i DNA-koden, føre til ødeleggende effekter. Spesielt gjelder det i kjønnskromosomene, da det vil lede til individer hvor alle cellene inneholder mutasjonen. Det kan f.eks. lede til barn som eldes da de er 10 år gamle, eller kvinner som får ondartet brystkreft før de blir 40 år gamle.
